Übergreifen der Vogelmalaria von Wildvögeln auf Zoovögel
In Zoos bietet die ständige Anwesenheit von Stechmücken wie der weit verbreiteten Nördlichen Hausmücke und von Wildvögeln als Träger verschiedener Krankheiten eine Nische für die Übertragung von Krankheiten. Krankheiten wie die Vogelmalaria werden nachweislich zwischen Wildvögeln und in Zoos gehaltenen Vögeln übertragen und stellen für Zoos weltweit eine Herausforderung dar.

Atlantische Papageientaucher im Tierpark Bern. Diese exotischen Vögel und weitere Vogelarten sind von Vogelmalaria betroffen. Bild © Tierpark Bern.
Steckbrief
- Die Vogelmalaria wird durch verschiedene Plasmodium-Parasiten verursacht.
- Die globale Erwärmung wird die Ausbreitung dieser Parasiten begünstigen.
- In der Schweiz wurden tödliche Fälle von Vogelmalaria bei in Zoos gehaltenen Papageientauchern und Wildvögeln gemeldet.
- Das Institut für Parasitologie der Universität Zürich arbeitet mit dem Zoo Zürich und dem Tierpark Bern zusammen, um die Übertragungswege der Vogelmalaria zu ermitteln.
- Unsere Forschungen haben gezeigt, dass die Vogelmalaria von Wildvögeln (Haussperlinge, Amseln) auf Zoovögel (Pinguine, Papageientaucher) über Stechmücken übertragen wird.
Systematik
- Reich
- Animalia
- Stamm
- Arthropoda
- Klasse
- Insecta
- Ordnung
- Diptera
- Familie
- Culicidae
- Gattung
- Culex
- Art
- C. pipiens
Über die Vogelmalaria
Die Vogelmalaria wird durch verschiedene Parasiten der Gattung Plasmodium verursacht, die von verschiedenen Stechmückenarten übertragen werden und mit Ausnahme der Antarktis weltweit verbreitet sind. Aufgrund der globalen Erwärmung und der damit einhergehenden Zunahme der Verbreitung von Vektoren* ist die Ausbreitung dieser Parasiten unvermeidlich. Die Auswirkungen der Vogelmalaria sind bei den verschiedenen Vogelarten unterschiedlich. Infizierte einheimische Vögel können asymptomatisch sein, aber in einigen Fällen kann die Krankheit die Fitness des Wirtes* beeinträchtigen. Wenn die Krankheit neu in eine Vogelpopulation eingeschleppt wird, können nicht angepasste Vögel der Infektion zum Opfer fallen. Dieses Szenario wurde im 20. Jahrhundert auf Hawaii beobachtet, wo die Vogelmalaria zum Rückgang der einheimischen Vogelarten beitrug.
Die Vogelmalaria ist eine der Haupttodesursachen in Pinguinpopulationen, die in Zoos gehalten werden. In der Schweiz wurden tödliche Fälle von Vogelmalaria bei in Zoos gehaltenen und wilden Vögeln gemeldet. Dieselben Parasitenarten, die in der Schweiz vorkommen, werden auch in den Nachbarländern gemeldet, so dass eine ständige Überwachung der Infektionen erforderlich ist.

Humboldtpinguin im Zoo Zurich. Bild © Enzo Franchini.
Unsere Forschung zur Vogelmalaria
Am Institut für Parasitologie der Universität Zürich (UZH) konzentrieren wir uns auf die Beschaffung von Daten über:
1. Vorkommen
2. Übertragung
3. und pathologische Wirkung
von Plasmodium-Parasiten bei Pinguinen und Papageientauchern, die in Zoos gehalten werden, sowie bei wildlebenden Sperlingsvögeln (Ordnung Passeriformes) wie Spatzen, Amseln und Kohlmeisen. Wir arbeiten mit dem Zoo Zürich und dem Tierpark Bern zusammen, um herauszufinden, wie Malariaparasiten zwischen in Zoos gehaltenen und chronisch infizierten Wildvogelarten übertragen werden, die eine Quelle der Krankheitsübertragung sein könnten.
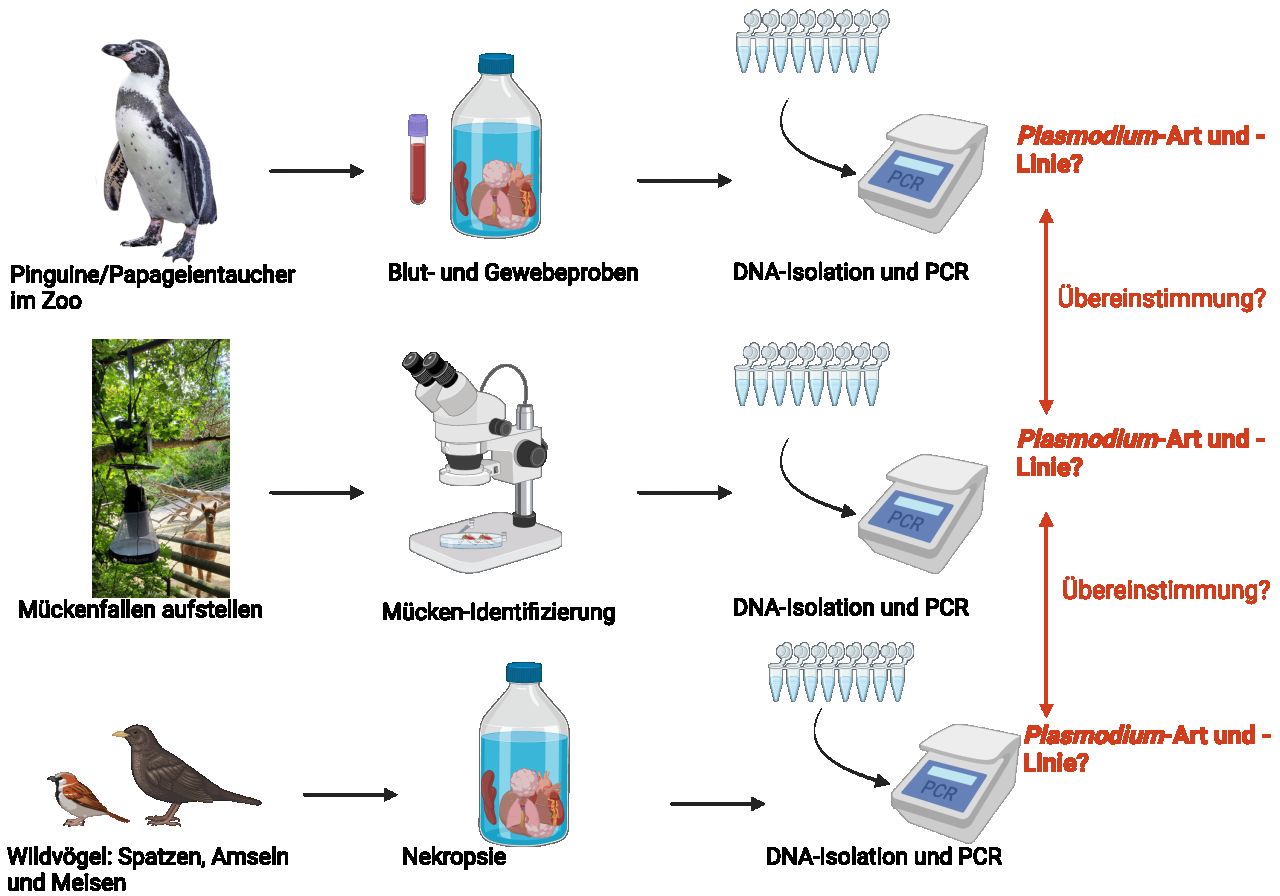
Analyse des Übertragungswegs von Plasmodium-Parasiten bei Vögeln. Die molekulare Analyse mittels PCR ermöglicht die Identifizierung der Parasiten, die die Pinguine und Papageientaucher, die Stechmücken und die Wildvögel infiziert haben. Wenn Art und Linie der Parasiten bei allen drei Arten übereinstimmen, kann man davon ausgehen, dass die im Zoo gehaltenen Pinguine und Papageientaucher von den Wildvögeln über die Stechmücken infiziert wurden. Bild erstellt mit Biorender.
1. Vektoranalyse: Auf der Suche nach dem Hauptverdächtigen, den Stechmücken
Um festzustellen, in welchen Vektoren die Parasiten vorkommen, identifizieren wir die Stechmücken, die die Parasiten übertragen, und führen eine Xenodiagnose* durch, um die Wirte der blutgefütterten Stechmücken zu ermitteln. Zu diesem Zweck stellen wir in beiden Zoos während der Frühjahrs- und Sommersaison Mückenfallen auf. Zunächst identifizieren und sezieren wir die gesammelten Stechmücken. Dann identifizieren wir die Parasitenarten und -linien* mit Hilfe der PCR*.
Ergebnis: Unsere Studie hat gezeigt, dass Culex pipiens der Hauptüberträger von Plasmodium-Parasiten bei Vögeln ist, wie dies auch in Übereinstimmung mit einer früheren Studie in der Schweiz (Glaizot O et al. 2012. PLoS One). Ausserdem haben wir bis zu vier verschiedene aviäre* Plasmodium-Linien in Stechmücken identifiziert, wobei Plasmodium relictum SGS1 die häufigste ist.
2. Natürliche Reservoirwirte: Die Übertragungskette über Vögel
Zum Nachweis und zur Identifizierung aviärer Plasmodium-Parasiten in potenziellen Zoo-Vogelwirten haben wir PCR an Blut- und Gewebeproben durchgeführt. Bei unseren Untersuchungen konnten wir bei Pinguinen und Papageientauchern dieselben Parasitenarten nachweisen wie bei Stechmücken, was auf einen plausiblen Übertragungsweg hindeutet. Die häufigsten Parasiten bei Pinguinen und Papageientauchern waren P. matutinum LINN1 und P. relictum SGS1.
Ergebnis: Unsere Analyse bei Wildvögeln (gleiches Verfahren wie bei Zoovögeln) hat Sperlinge und Amseln als potenzielle Wildreservoirwirte für aviäre Plasmodium-Arten identifiziert. Wir haben in einem besonderen Fall P. relictum GRW11 bei einer wild adoptierten Haustaube gefunden (Muchaamba G et al. 2024. Malar J). Diese Information ist wichtig, da diese wilden Reservoirwirte die Lücke in der Übertragung zwischen wilden Zugvögeln und in Zoos gehaltenen Vögeln schliessen.
3. Pathologische Auswirkungen: Komplizierte Diagnose
Ausserdem untersuchten wir Gewebe der infizierten Vögel, um die pathologischen Auswirkungen der Parasiten in den verschiedenen Wirten zu bestimmen. Wie bei der Malariainfektion des Menschen können Plasmodium-Parasiten bei Vögeln die Zerstörung der roten Blutkörperchen und eine Anämie verursachen. Bei Malariainfektionen von Vögeln durchläuft der Parasit jedoch ein zweites Entwicklungsstadium in verschiedenen Geweben der Vogelwirte, das ebenfalls zu einer Erkrankung führen kann. Diese Gewebestadien sind für die Aufrechterhaltung der Infektion in der chronischen/latenten Phase verantwortlich und können zu einem erneuten Auftreten der Infektion führen. Dieses Szenario ist noch wenig erforscht, aber die aus toten Vögeln gewonnenen Informationen werden uns helfen, die Wirt-Parasit-Interaktion aufzudecken.
Ergebnis: Unsere Analyse hat gezeigt, dass die Infektion bei Pinguinen vor allem in den Geweben und kaum im Blut nachgewiesen wird, was die Diagnose durch Blutproben erschwert. Die Entwicklung serologischer* Tests zur Bestimmung der Antikörper gegen die Parasiten könnte die Diagnose der Vogelmalaria erleichtern.
Wie können wir die Vogelmalaria bekämpfen?
Die Bekämpfung der Vogelmalaria sollte sich auf die Kontrolle der Vektoren (Stechmücken) und die Überwachung/Reduzierung der Reservoirwirte (Wildvögel) konzentrieren. Letzteres ist in einem Zoo nicht praktikabel, da Schädlingsvögel und andere Wildvögel im Überfluss vorhanden sind. Um die Übertragung zu verringern, werden prophylaktische* Massnahmen empfohlen und während der Hochsaison des Vektors durchgeführt, einschliesslich der Trockenlegung stehender Gewässer, der Behandlung von Mückenlarven mit einem Insektizid und der Unterbringung von Pinguinen und Papageientauchern in Innenräumen, um Mückenstiche zu vermeiden.
Ein Impfstoff auf DNA-Basis wurde bereits an Pinguinen erprobt, und es konnte gezeigt werden, dass er die Anzahl der Parasiten im Blut infizierter Vögel reduziert. Der Impfstoff führte jedoch nur zu einer kurzfristigen Immunität in den folgenden Jahren und wird daher nicht verwendet.
Zusätzlich zu diesen präventiven Massnahmen tragen wir gemeinsam mit den beiden Zoos zur Überwachung der Infektionen bei, indem wir die Vögel untersuchen, um eine rechtzeitige Behandlung mit Malarone (Atovaquon und Proguanil) sicherzustellen. Diese Kombination wird bei Malaria bei Menschen und Vögeln eingesetzt und ist dafür bekannt, dass sie die Parasiten im Blut wirksam beseitigt. In Fällen, in denen sich die Parasiten im Gewebe befinden, müssen jedoch bessere Behandlungsmöglichkeiten wie Tafenoquin getestet werden, die auf die Parasiten im Gewebe abzielen (https://www.nzgeo.com/stories/when-birds-get-sick/).
Beteiligte Teams
Muchaamba Gillian, Marti Matthias; Institut für Parasitologie, Vetsuisse-Fakultät, UZH; https://www.paras.uzh.ch/de/research/Malaria-Transmission-Lab.html
Hatt Jean-Michel and Kummrow Maya; Klinik für Zoo-, Heim- und Wildtiere, Vetsuisse-Fakultät, UZH.
Hetzel Udo, Kipar Anja, Dervas Eva; Institut für Veterinärpathologie, Vetsuisse-Fakultät, UZH.
Davis Leyla; Zoo Zurich https://www.zoo.ch/en/conservation-animals/research-zoo/mosquitoes-vectors-avian-malaria
Huwiler Meret- Tierpark Bern
Albini Sarah; Veterinärbakteriologie und Geflügel- und Kaninchenkrankheiten, Institut für Lebensmittelsicherheit und -hygiene, Vetsuisse-Fakultät, UZH
Keller Saskia und Imlau Michelle; Institut für Fisch- und Wildtiergesundheit, Vetsuisse-Fakultät, Bern.
*Glossar:
Aviär: von Vögeln stammend oder auf Vögel bezogen
Linie: Die genetische Linie von Plasmodium basiert auf der Sequenzierung des Cytochrom-b-Gens.
PCR: Abkürzung für "polymerase chain reaction" (Polymerase-Kettenreaktion). Mit dieser Methode wird ein genau definierter kurzer DNA-Abschnitt in einer Probe vervielfältigt und nachgewiesen.
Prophylaktisch: Dient der Vorbeugung von Krankheiten.
Reservoirwirt: Ein Organismus, der einen Parasiten beherbergt, als Infektionsquelle dient und ihn auf einen potenziellen Wirt überträgt. Reservoirwirte sind oft asymptomatisch.
Serologisch: Serologische Tests dienen dem Nachweis von Antikörpern und Antigenen in einer Patientenprobe, in der Regel im Blutserum.
Vektor: Überträger von Krankheitserregern. Im Falle der Malaria sind es Stechmücken, die die krankheitsverursachenden Plasmodium-Parasiten übertragen.
Wirt: Ein Organismus, der einem anderen Organismus vorübergehend oder dauerhaft als Lebensraum dient oder ihm Nahrung, Schutz oder die Möglichkeit zur Vermehrung bietet. Der Mensch zum Beispiel ist ein Wirt für Stechmücken, die sich bei ihm mit Blut versorgen, oder für Malaria-Parasiten, die sich in ihm vermehren.
Xenodiagnose: Die Xenodiagnose ist eine Methode zum Nachweis, ob ein Wirt mit einem Krankheitserreger infiziert ist. Dabei wird das Gewebe des Tieres, bei dem ein Infektionsverdacht besteht, einem Vektor ausgesetzt. Der Vektor wird dann analysiert, um festzustellen, ob er Krankheitserreger aufgenommen hat. Im vorliegenden Fall werden potenzielle Reservoir-Wirte (Vögel) durch die Analyse von Wirtsblut, das von Moskitos aufgenommen wurde, auf das Vorhandensein von Krankheitserregern (Plasmodium) untersucht.
Quellen
Schoenle LA et al. 2017. An experimental test of the physiological consequences of avian malaria infection. Journal of Animal Ecology 86;(6):1483-1496. https://doi.org/10.1111/1365-2656.12753
Marzal A et al. 2005. Malarial parasites decrease reproductive success: An experimental study in a passerine bird. Oecologia 142;4:541-545. https://doi.org/10.1007/s00442-004-1757-2
van Riper C et al. 1986. The epizootiology and ecological significance of malaria in Hawaiian land birds. Ecological Monographs 56;4:327-344. https://doi.org/10.2307/1942550
González-Olvera M et al. 2022. Molecular and epidemiological surveillance of Plasmodium spp. during a mortality event affecting Humboldt penguins (Spheniscus humboldti) at a zoo in the UK. International Journal for Parasitology: Parasites and Wildlife 19:26-37. https://doi.org/10.1016/j.ijppaw.2022.06.010
Meister S et al. 2021. Fatal avian malaria in captive Atlantic puffins (Fratercula arctica) in Switzerland. International Journal for Parasitology: Parasites and Wildlife 14. https://doi.org/10.1016/j.ijppaw.2020.12.007
Pendl H et al. 2022. Exo-erythrocytic development of Plasmodium matutinum (lineage pLINN1) in a naturally infected roadkill fieldfare Turdus pilaris. Malaria Journal 21;1:148. https://doi.org/10.1186/s12936-022-04166-x
Iurescia M et al. 2021. Plasmodium matutinum Transmitted by Culex pipiens as a Cause of Avian Malaria in Captive African Penguins (Spheniscus demersus) in Italy. Frontiers in Veterinary Science 8. https://doi.org/10.3389/fvets.2021.621974
Köchling K et al. 2023. Avian Plasmodium spp. and Haemoproteus spp. parasites in mosquitoes in Germany. Parasit Vectors 16;1:369. https://doi.org/10.1186/s13071-023-05965-0
Cranfield M et al. 1990. A review and update of avian malaria in the African penguin (Spheniscus demersus). Proceedings of the American Association of Zoo Veterinarians; 243-248.
Glaizot O et al. 2012. High prevalence and lineage diversity of avian malaria in wild populations of great tits (Parus major) and mosquitoes (Culex pipiens). PloS one 7;4:e34964-e34964. https://doi.org/10.1371/journal.pone.0034964
Grim KC et al. 2004. Preliminary results of an anticircumsporozoite DNA vaccine trial for protection against avian malaria in captive African black-footed penguins (Spheniscus demersus). Journal of Zoo and Wildlife Medicine 35;2:154-161. https://doi.org/10.1638/03-060
Muchaamba G et al. 2024 Avian malaria in a feral-pet pigeon: a case report. Malar J 2;23(1):294. https://malariajournal.biomedcentral.com/articles/10.1186/s12936-024-05116-5



